氮化硅是一种新式无机非金属资料主要有α-氮化硅和β-两种晶型它们都是由[SiN4]正四面体共用顶角原子构成的三维空间网络结构β的结构如图所示:用甘氨酸(H2NCH2COOH)
描述:
...产品详细
)为氧化剂,原硅酸为硅源,蔗糖为碳源,进行反响制备氮化硅.答复下列问题:
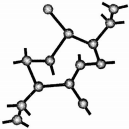
(1)1mol甘氨酸分子中含有σ键的数目为___,组成该物质的各元素榜首电离能由小到大的次序为___.
(2)尿素分子中碳的杂化方法为___,尿素作配体时能作为配位原子的是___.
(3)NH4NO3中阴离子的空间构型为___,由第1、2周期元素能成的与该阴离子互为等电子体的离子是___.
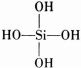
(原硅酸根)为硅氧四面体结构,顶角上的4个氧原子称作“角氧”.3个硅氧四面体互相用3个角氧相连后,构成离子的化学式为___.n个硅氧四面体互相用4个角氧衔接后构成的物质的化学式是___.

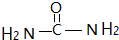
杂化,由于配体中配位原子供给孤对电子,所以尿素作配体时能作为配位原子的是O、N,故答案为:sp
(3)NH4NO3中阴离子为硝酸根离子,其中价层电子对个数=σ键个数+孤电子对个数=3,且不含孤电子对,所以硝酸根离子为平面三角形;依据等电子体概念可知,原子数和价电子数都持平的微粒互为等电子体,NO3-离子中有四个原子,价电子数为24,所以与NO3-离子互为等电子体的一种离子为CO32-等,故答案为:平面三角形,CO32-;
(4)1个硅氧四面体为SiO44-,则3个硅氧四面体互相用3个角氧相连,即构成的Si3O96-离子;n个硅氧四面体互相用四个角氧衔接后构成空间网状结构的晶体,是经过Si-O共价键结合构成是二氧化硅,故答案为:Si3O96-;SiO2.
(5)由氮化硅的结构为硅和氮以共价键结合的空间网状结构,得出归于原子晶体,
